| Niti-S大腸用ステントMD/BBタイプ 多施設共同前向き安全性観察研究 研究計画書 | PDF形式 | 916Kバイト |  |
★Niti-S_MDBB_study_PRT_ver3.0.pdf |
| WORD形式 | 198Kバイト |  |
★Niti-S_MDBB_study_PRT_ver3.0.docx |
課題名
Niti-S 大腸用ステントMD/BBタイプ多施設共同前向き安全性観察研究
研究代表者所属:国立病院機構呉医療センター・中国がんセンター
研究代表者名:桑井 寿雄
大腸ステント安全手技研究会
Ver.1.0 平成30年9月14日(代表施設倫理審査委員会初回承認)
Ver.2.0 平成31年1月10日
Ver.2.1 2019年5月24日
Ver.3.0 2021年5月28日
本文書中の情報は、本臨床研究の直接関係者(実施医療機関の長、研究事務局、研究代表者、研究責任者、研究分担者、臨床研究協力者及び倫理審査委員会等)に限定して提供しています。したがって、臨床研究に参加する研究対象者から同意を取得する場合を除き、研究代表者の事前の同意なしに、本臨床研究と関係のない第三者に情報を開示することはできません。
0. 概要
0.1. シェーマ(研究概要図)
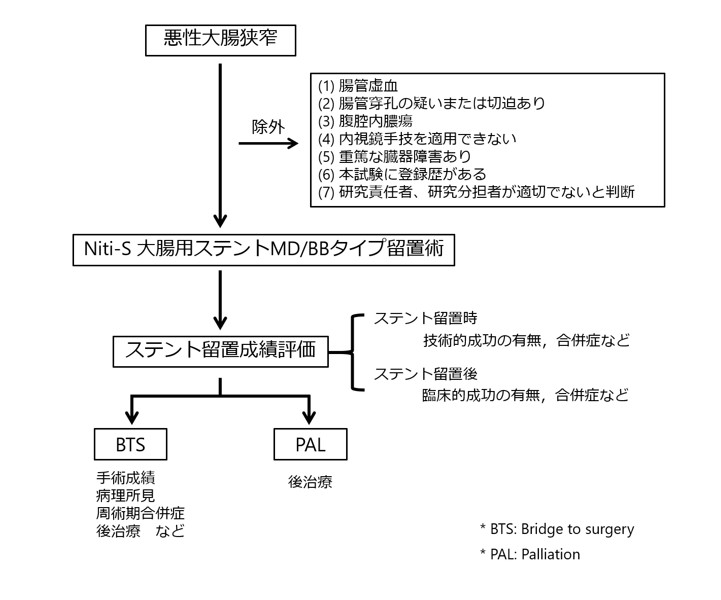
0.2. 目的
本観察研究の目的は、悪性結腸直腸閉塞の治療におけるNiti-S大腸用ステントMD/BBタイプの臨床使用経験を蓄積し、その有効性と安全性を評価する事である。
0.3. 評価項目
主要評価項目
副次評価項目
0.4. 主な適格基準
0.4.1. 選択基準
以下の基準を全て満たす患者とする。
0.4.2. 除外基準
以下のいずれかに該当する患者は本研究に組み入れないこととする。
0.5. 目標登録症例数
200症例
0.6. 研究期間
各研究対象者の研究期間は、同意取得日から最終観察日または中止判断日までとする。中止判断日とは研究責任者または研究分担者が、当該研究対象者での研究の中止を判断した日とする。
研究対象者登録期間:倫理審査委員会承認後から4年0ヵ月
観察期間:最終研究対象者(中止症例を除く)登録から1年
総研究期間:倫理審査委員会承認日から2023年12月
0.7. 研究デザイン
多施設共同前向き観察研究
0.8. 研究代表者連絡先
独立行政法人国立病院機構 呉医療センター・中国がんセンター 消化器内科
内視鏡センター長 桑井 寿雄
住所: 広島県呉市青山町3-1
TEL: 0823-22-3111 (代表)

0.2. 目的
本観察研究の目的は、悪性結腸直腸閉塞の治療におけるNiti-S大腸用ステントMD/BBタイプの臨床使用経験を蓄積し、その有効性と安全性を評価する事である。
0.3. 評価項目
主要評価項目
- 大腸ステント留置術の臨床的成功率
副次評価項目
- 大腸ステント留置術の手技的成功率
- 大腸ステント留置による合併症発生割合
- 周術期合併症発生割合(BTS症例)
- 一期的腸管吻合率(BTS症例)
- 全生存期間 (OS)
0.4. 主な適格基準
0.4.1. 選択基準
以下の基準を全て満たす患者とする。
- 腹部CTなどの検査により、悪性新生物によって生じた結腸直腸閉塞の術前処置BTSおよび緩和治療を必要とする患者
- Niti-S大腸用ステントMD/BBタイプの留置を予定している患者
- 大腸用ステント留置術を受けたことのない患者
- 性別不問
- 本人から自由意志による文書同意が得られた患者
0.4.2. 除外基準
以下のいずれかに該当する患者は本研究に組み入れないこととする。
- 腸管虚血を認める患者
- 腸管穿孔の疑いまたは切迫を認める患者
- 腹腔内膿瘍を認める患者
- 内視鏡手技を適用できない患者
- 重篤な臓器障害がある患者
- 本試験に登録歴がある患者
- 研究責任者、研究分担者が本研究の参加について適切でないと判断した患者
0.5. 目標登録症例数
200症例
0.6. 研究期間
各研究対象者の研究期間は、同意取得日から最終観察日または中止判断日までとする。中止判断日とは研究責任者または研究分担者が、当該研究対象者での研究の中止を判断した日とする。
研究対象者登録期間:倫理審査委員会承認後から4年0ヵ月
観察期間:最終研究対象者(中止症例を除く)登録から1年
総研究期間:倫理審査委員会承認日から2023年12月
0.7. 研究デザイン
多施設共同前向き観察研究
0.8. 研究代表者連絡先
独立行政法人国立病院機構 呉医療センター・中国がんセンター 消化器内科
内視鏡センター長 桑井 寿雄
住所: 広島県呉市青山町3-1
TEL: 0823-22-3111 (代表)
目 次
※項目をクリックすると該当記事に移動します。
0.
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
22.
23.
24.
25.
25.1.
25.1.1.
25.1.2.
25.1.3.
25.1.4.
25.2.
25.2.1.
25.2.2.
25.2.3.
25.2.4.
※項目をクリックすると該当記事に移動します。
0.
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
22.
23.
24.
25.
25.1.
25.1.1.
25.1.2.
25.1.3.
25.1.4.
25.2.
25.2.1.
25.2.2.
25.2.3.
25.2.4.
1. 目的
本観察研究の目的は、悪性結腸直腸閉塞の治療におけるNiti-S大腸用ステントMD/BBタイプの臨床使用経験を蓄積し、その有効性と安全性を評価する事である。
2. 背景と根拠,本研究の意義
悪性大腸閉塞は大腸癌患者の8-14.2%に発生し1)-5)、標準治療として人工肛門造設を含めた緊急手術が行われてきた。しかし、待機的な手術と比較して予後が不良であることが知られており6)、多くの場合に患者のquality of life (QOL)低下は免れない。その問題を解決するため、大腸閉塞減圧目的に1990年代初めに大腸ステントが根治的な手術のできない患者に対する緩和治療(palliation: PAL)に導入され7)、その後、術前減圧目的のbridge to surgery (BTS)への適応が拡大された8),9)。2010年には,米国消化器内視鏡学会 (the American Society for Gastrointestinal Endoscopy)やWorld Society of Emergency Surgeryのガイドラインにも大腸悪性狭窄に対しては大腸ステントの減圧が標準とされた10),11)。大腸ステントは本邦でも2012年から保険収載されて広く臨床に導入されているが、そのエビデンスは有用性や限界なども含めまだ確立していない。
我々は、本研究に先立ち、日本消化器内視鏡学会関連研究会である「大腸ステント安全手技研究会」のもと、東邦大学医療センター大橋病院が主任研究施設となり、全国の50施設が参加する多施設共同研究である、大腸ステント前向き安全性観察研究(UMIN000007953,UMIN000011304)を行い、WallFlex stent、Niti-S Enteral Colonic Uncovered Stent、 D-typeを用いた大腸ステント留置の安全手技を確立し、学会活動を通してその啓蒙を行ってきた。その2つの多施設共同前向き研究12),13)では、技術的成功率がそれぞれ98%と99%、臨床的成功率は96%と97%、穿孔率は2%と0%で非常に良好な成績であった。
今回、新たなステントであるNiti-S Enteral Colonic Uncovered Stent、 MD/BB-typeが薬事追加された。本ステントはD-typeと同様の外径 (22mm)であるにも関わらず、デリバリーシステムが9Frであり、鉗子口径が3.2mm以上であれば使用できるため細径大腸内視鏡スコープでの処置が可能となった初めてのステントである(今まではデリバリーシステムが9Frのステントは外径18mmのものだけであった)。そのため、播種を来しその影響で腸管の癒着を認めている症例でもスコープ操作が比較的容易となり、また先端硬性部が短いため処置の際に正面視できるといった利点がある。さらに、使用するステント径に関する検討では、ステント径が小さいことで逸脱や閉塞などの合併症が増加すると報告されており14)~16)、本ステントは外径の細いタイプのステントより再閉塞を予防できると期待される。
本ステントに関する、全国的な大腸ステントの安全な手技の啓蒙を目指す事は、新たな安全に使用できる大腸ステントの選択肢を増やすだけでなく、本邦の大腸悪性狭窄患者のQOLの向上およびその安全性情報の世界へ向けた発信としても意義は大きい。このため、新たに本ステントが保険収載されるにあたり、その有効性および安全性の本邦における評価が必要と考え、本研究を検討することとした。 なお本研究も、日本消化器内視鏡学会関連研究会である「大腸ステント安全手技研究会」 のもと、全国の約50施設が参加する多施設共同研究となる。
3. 目標登録症例数と研究期間
3.1. 目標登録症例数
研究全体:200例
3.2. 研究期間
各研究対象者の研究期間は、同意取得日から最終観察日または中止判断日までとする。中止判断日とは研究責任者または研究分担者が、当該研究対象者の研究への参加中止を判断した日とする。
研究対象者登録期間:倫理審査委員会承認後から4年0ヵ月
観察期間:最終研究対象者(中止症例を除く)登録から1年
総研究期間:倫理審査委員会承認日から2023年12月
研究対象者登録期間:倫理審査委員会承認後から4年0ヵ月
観察期間:最終研究対象者(中止症例を除く)登録から1年
総研究期間:倫理審査委員会承認日から2023年12月
4. 症例登録
4.1. 症例登録手順
研究対象者がすべての適格基準を満たしていると判断した時点で、研究責任者又は研究分担者は、電子データ収集システム (EDC:Electronic data capturing) を用いて症例登録を行い、EDCより症例登録番号が発番される。登録施設は、研究終了までの対象全例の登録を行うこととする。
5. 研究の終了と早期中止
5.1. 研究の終了
最後に登録した対象者における最終観察日が終了した時点、当該対象者の研究参加を中止した時点、または当該対象者が来院しなくなった時点 (すなわち、研究責任者または研究分担者が当該対象者と連絡を取れなくなった時点) で終了とする。
5.2. 研究の早期中止
研究代表者は倫理審査委員会などによる勧告があった場合を含み、対象者全体でのリスクと利益のバランスが許容しがたい場合、研究の中止を決定することがある。研究計画書または規制要件に対する不遵守、実施手順の問題、あるいは管理上の理由による研究参加中止の対象者数が多い場合は、研究の組み入れまたは特定の施設の組み入れを中止することがある。
6. 適格基準
6.1. 選択基準
以下の基準を全て満たす患者を登録することとする。- 腹部CTなどの検査により、悪性新生物によって生じた結腸直腸閉塞の術前処置BTSおよび緩和治療を必要とする患者
- Niti-S大腸用ステントMD/BBタイプの留置を予定している患者
- 大腸用ステント留置術を受けたことのない患者
- 性別不問
- 本人から自由意思による文書同意が得られた患者
6.2. 選択基準設定の根拠
- 登録時は腹部CTなどの非侵襲的検査での診断となるため設定した。登録時点で病理検査による確定診断は必要なく、登録後に大腸内視鏡検査あるいは手術所見による最終診断とする。 なお登録時点で病理診断がある場合には、大腸癌取扱い規約第9 版における腺癌(粘液癌、印環細胞癌を含む)と診断されているものとする。
- 他のステントの使用患者を除外するため設定した。
- 本研究における観察項目への影響を考慮し設定した。
- 対象疾患は男女とも発症するため設定した。
- 本研究において遵守すべき倫理指針に従って設定した。
6.3. 除外基準
以下のいずれかに該当する患者は本研究に組み入れないこととする。- 腸管虚血を認める患者
- 腸管穿孔の疑いまたは切迫を認める患者
- 腹腔内膿瘍を認める患者
- 内視鏡手技を適用できない患者
- 重篤な臓器障害がある患者
- 本試験に登録歴がある患者
- 研究責任者、研究分担者が本研究の参加について適格でないと判断した患者
6.4. 除外基準設定の根拠
(1)、(2)、(3)、(4)、(5)、(6) 患者の安全性を確保するため設定した。(7) 被験者の安全性を確保する上で、また適正に試験を実施する上で、不適格である患者を担当医が除外できる余地を残すために設定した。
6.5.中止基準
以下のいずれかに該当する場合は、研究対象者の研究への参加を中止する。- 研究対象者から同意撤回の申し出があった場合
- 転居などにより研究対象者が来院しない場合
- 研究対象者が死亡した場合
- 登録後不適格症例であることが判明した場合
6.6. 診断基準と病期・病型・病態分類
本研究では「大腸癌取り扱い規約 第9版」を基準とする。また臨床病期分類および病理学的病期分類は「TNM分類第8版 (UICC-TNM 2017年版)」も使用する (主要部分は 25.1 付録、診断基準に記載)。
6.6.1. CROSS (ColoRectal Obstruction Scoring System) (大腸閉塞スコア)
0:継続的な腸管減圧を要する
1:経口摂取不能
2:水分、経腸栄養剤もしくは完全流動食*が摂取可能
3:食事 (低残渣/粥/普通食) 摂取可能で、腸管閉塞症状**あり
4:食事 (低残渣/粥/普通食) 摂取可能で、腸管閉塞症状なし
*:完全流動食とは、ストローなどで飲める状態のものを指す。
**:腸管閉塞症状とは、食事により引き起こされる、腹痛、腹部膨満、悪心、嘔吐、便秘および下痢を指す。
6.6.2. Performance Status (ECOG)
| Score 0: | 全く問題なく活動できる。発病前と同じ日常生活が制限なく行える。 |
| Score 1: | 肉体的に激しい活動は制限されるが、歩行可能で、軽作業や座っての作業は行うことができる。 例:軽い家事、事務作業 |
| Score 2: | 歩行可能で自分の身の回りのことはすべて可能だが作業はできない。日中の50%以上はベッド外で過ごす。 |
| Score 3: | 限られた自分の身の回りのことしかできない。日中の50%以上をベッドか椅子で過ごす。 |
| Score 4: | 全く動けない。自分の身の回りのことは全くできない。完全にベッドか椅子で過ごす。 |
6.6.3. 米国麻酔学会術前状態分類 (ASA physical status classification)
| Class 1: | 一般的に良好。合併症無し |
| Class 2: | 軽度の全身疾患を有するが日常生活動作は正常 |
| Class 3: | 高度の全身疾患を有するが運動不可能ではない |
| Class 4: | 生命を脅かす全身疾患を有し、日常生活は不可能 |
| Class 5: | 瀕死であり手術をしても助かる可能性は少ない |
| Class 6: | 脳死状態 |
7. 対象機器
本研究で使用する大腸用ステントは、ニッケルチタン合金製ワイヤーを編み込んだ、自己拡張型金属ステントである(直径22mm, 長さ6, 8, 10, 12cm,デリバリーシステムの外径9Fr)。アキシャルフォースの低減を目的に、本品はステントの網目が交互にかみ合わせるように編まれている。この網目構造及び原材料はNiti-S胃十二指腸用ステントと同一である。ステントにはプラチナ/イリジウム合金製のX線不透過マーカーがワイヤーの両端及び中央部に固定されている。ステントは予めデリバリーシステムに装填されており、自己拡張機能を有するステントが狭窄部に留置されることにより管腔を維持する。デリバリーシステムについても、Niti-S胃十二指腸用ステントと同一であり、インナーカテーテルは、中央に0.035インチのガイドワイヤーを通すルーメンがある。本品は内視鏡の最小チャンネル径3.2mmのワーキングチャンネルを通して挿入することができる初めての直径22mmの大腸ステントである。デリバリーシステムにはアウターシース先端、ステント搭載時のステント両端および中央部の4ヶ所X線不透過マーカーが配置されている。本品はMRIとの併用について、3テスラ以下のMRI環境下では、患者に対しリスクや有害事象の発生を増大させることはない。
なお、ステントによって、磁場の歪みによるアーチファクトが生じる可能性があることに留意する必要がある。本品はエチレンオキサイドガス処理によって滅菌された状態で供給されるが、高温、多湿、直射日光及び水濡れを避けて保管する必要がある。本品は一人の患者さんにのみ使用されるよう設計されている(Single use only)。
なお、ステントによって、磁場の歪みによるアーチファクトが生じる可能性があることに留意する必要がある。本品はエチレンオキサイドガス処理によって滅菌された状態で供給されるが、高温、多湿、直射日光及び水濡れを避けて保管する必要がある。本品は一人の患者さんにのみ使用されるよう設計されている(Single use only)。
8. 観察・報告項目とスケジュール
8.1. 研究対象者の研究参加期間
治療期間(通常の診療に基づく):4週間観察期間:12ヶ月
術前処置BTSとしてステントを留置した対象者は手術の後の退院時でフォローアップ終了となる。緩和治療目的の患者フォローアップは留置後12ヶ月間とする。術前処置 BTS として留置した後に緩和治療目的となった場合にはそのまま12ヶ月間のフォローアップを行う。
8.2. 観察項目
- 患者背景:年齢、性別、既往歴、合併症
- 身体所見:身長、体重、BMI、PS (ECOG)、ASA、CROSS
- 自他覚症状(閉塞症状):腹満、腹痛、便通異常、悪心、嘔吐など
- 血液学的検査:血算(WBC、好中球、RBC、Hb、Ht、PLT)、凝固検査(PT-INR、APTT、D-dimer)
- 血液生化学検査:アルブミン、総蛋白、総ビリルビン、AST、ALT、γGTP、ALP、LDH、BUN、Cre、Ca、Na、K、Cl、CRP、eGFR
- 画像検査:基本的に胸腹部CTだが、必要に応じて脳CTなども加える。またFDG‐PETやMRIでの代替も可能。診断時に、病期分類(「26.1.3.進行度(stage)分類(大腸癌取り扱い規約 第9版)」、「26.1.4.病期分類基準(TNM分類 第7版)」)および臨床病理(原発腫瘍の主占居部位)を評価する。
- 大腸内視鏡検査:病変部位、閉塞状況、肉眼的分類
- 生検:原発巣の主な組織型
- ステント留置成績:
1) ステント留置時
狭窄長、手技時間(留置開始日時、留置終了日時)、ステント留置責任者、留置術中もしくは留置術後の遊離ガス像(腸管損傷)の有無、ステント留置中止有無(有の場合は、中止の理由)、使用したステントの種類および本数(ステントの種類、ステントのサイズ、ステントの太さ、本数、複数本使用した場合は理由)、留置箇所、技術的成功(不成功の場合は、理由)2) ステント留置後
ステント留置に伴う合併症(「10.2.2. 大腸ステント留置による合併症発生割合」穿孔、逸脱、再閉塞、腫瘍、出血など)、ステント留置の臨床的成功、原発巣摘出術前退院の有無 - 手術成績:
再入院の有無、原発巣摘出の有無、手術担当医、手術時間、手術目的(待機または緊急)、術式(腹腔鏡下または開腹)、腸切除の有無、ストーマ造設の有無(有の場合は、吻合・腫瘍切除の有無)、腫瘍主占居部位、腹腔内へのステント露出の有無、出血量、術中輸血の有無、術後輸血の有無、合併切除臓器、一期的腸管吻合の有無、肉眼的な閉塞性腸炎の有無、郭清度
- 術後病理所見:
原発巣の主組織型(「25.1.2.組織学的所見(大腸癌取り扱い規約 第9版)」)、肉眼型分類、腫瘍径、病理学的病期分類(「25.1.3.進行度(stage)分類(大腸癌取り扱い規約 第9版)」、「25.1.4.病期分類基準(TNM分類 第8版)」)、組織学的切除近位断端・組織学的切除遠位断端・組織学的外科剥離面(「15.2.2切除断端における癌浸潤」)、手術治療後の癌遺残(「15.2.3手術治療後の癌遺残」)、根治度(「15.2.4根治度(手術治療)」
- CEA 、CA19-9:大腸癌の腫瘍マーカーとして測定する。
- 周術期合併症:
1)原発巣摘出手術時「10.2.2. 周術期合併症発生割合」の「(1)術中合併症」について2)原発巣摘出手術後「10.2.2. 周術期合併症発生割合」の「(2)術後早期合併症」について3)観察期間、観察終了時「10.2.2. 周術期合併症発生割合」の「(3)術後晩期合併症」について
- 後治療/補助化学療法:
PS(ECOG)、ストーマの有無、ストーマ閉鎖術の有無、化学療法(PAL症例)/補助化学療法(BTS症例)の有無(有の場合は、治療法、実施期間、投与完了コース数、中止の有無)
- 生存状況:
生存状況(生存、死亡、不明)、生存状況確認日、死亡日、死因、転移・再発の有無(有の場合は、診断日、根拠、転移・再発部位)、二次がん発生の有無(有の場合は、診断日および詳細)
8.3. 検査および観察スケジュール
本研究は観察研究であり、研究に携わる医師は各実施医療機関の通常の治療方法を変更することなく、対象者は通常診療に基づいて治療を受ける。BTS例
| 項目 | 診断時 (ステント留置前) | ステント 留置時 | 原発巣摘出 手術前 |
原発巣摘出 手術時 | 観察終了時 |
|---|---|---|---|---|---|
| 時 期 | 0週 | 診断後できるだけ早く | ステント留置2週間後 | ステント留置2週間後 | 退院時 |
| 同意取得 | ● | ||||
| 患者背景 | ● | ||||
| 身体所見 | ● | ● | |||
| 自他覚症状 (閉塞症状) | ● | ● | |||
| 血液学的検査 | ● | ● | ● | ||
| 生化学検査 | ● | ● | ● | ||
| 画像検査 | ● | △ | |||
| 大腸内視鏡検査 | ● | △ | |||
| 生検 | △ | △ | △ | ||
| ステント留置成績 | <-----------------------------> | ||||
| 手術成績 | ● | ||||
| 術後病理所見 | ● | ||||
| CEA | ● | △ | |||
| CA19-9 | ● | △ | |||
| 周術期合併症 | ● | ● | |||
| 項目 | 診断時 (ステント留置前) | ステント 留置時 | ステント 留置後 |
観察期間 | 観察終了時 |
|---|---|---|---|---|---|
| 時 期 | 0週 | 診断後できるだけ早く | ステント留置 2週間後 | ステント留置 2週間後〜12ヶ月後 | ステント留置 12ヶ月後 |
| 同意取得 | ● | ||||
| 患者背景 | ● | ||||
| 身体所見 | ● | ● | |||
| 自他覚症状 (閉塞症状) | ● | ● | ● | ● | |
| 血液学的検査 | ● | ● | △ | △ | |
| 生化学検査 | ● | ● | △ | △ | |
| 画像検査 | ● | △ | △ | △ | |
| 大腸内視鏡検査 | ● | ||||
| 生検 | △ | △ | |||
| ステント留置成績 | <----------------------------------------------------> | ||||
| CEA | ● | △ | △ | ||
| CA19-9 | ● | △ | △ | ||
| 後治療/ 化学療法 | △ | △ | |||
| 生存状況 | ● | ● | |||
*:原則同意取得の1週間前まで許容する。
●印はそれぞれの時期に行う項目、△印はいずれかの時期、または必要と考えられた時に行う項目。時期はいずれも目安であり、治療時期を規定するものではない。
●印はそれぞれの時期に行う項目、△印はいずれかの時期、または必要と考えられた時に行う項目。時期はいずれも目安であり、治療時期を規定するものではない。
9. 評価項目
9.1. 評価項目
9.1.1. 主要評価項目
- 大腸ステント留置術の臨床的成功率
9.1.2. 副次評価項目
- 大腸ステント留置術の手技的成功率
- 大腸ステント留置による合併症発生割合
- 周術期合併症発生割合(BTS症例)
- 一期的腸管吻合率(BTS症例)
- 全生存期間 (OS)
9.2. 評価基準
9.2.1. 主要評価項目
- 大腸ステント留置術の臨床的成功率
1) 24時間以内に画像で閉塞の解除を確認できる場合。
2) 有症状例では症状の低減。
3) イレウス管挿入例ではステントに変更しても症状の増悪がない場合。
臨床的成功率は「臨床的成功症例数/登録数 (BTS例)」で算出する。
9.2.2. 副次評価項目
- 大腸ステント留置術の手技的成功率
手技的成功は狭窄部位へ1回で適切なステント留置ができた場合とし、手技的成功率は「手技的成功症例数/登録数」で算出する。 - 大腸ステント留置による合併症発生割合
予想される合併症は、穿孔、逸脱、再閉塞、出血、腹痛、死亡などがあげられる。頻度としては穿孔 3.8%、逸脱 11.8%、再閉塞 7.3%、出血と腹痛は頻度不明、死亡 0.6%と報告されている17)。上記に加え研究責任者あるいは担当医がステント留置術に関連する合併症と判断した場合に登録する。
ステント留置日をday1としday7までに発生した合併症を「早期合併症」と定義し、それ以降発生した合併症を「晩期合併症」と定義しそれぞれについて以下のように合併症発生割合を算出する。
- 早期合併症発生割合「早期合併症発生症例数/登録数」
- 晩期合併症発生割合「晩期合併症発生症例数/登録数」
- 周術期合併症発生割合(BTS症例)
本研究における周術期合併症は「有害事象共通用語規準 (NCI-Common Terminology Criteria for Adverse Events (CTCAE) v4.0日本語訳JCOG版」および「JCOG術後合併症基準 (Clavien-Dindo 分類)」を用いて評価する。
「術中合併症」を開腹開始から手術終了 (閉腹) まで、「術後早期合併症」を手術終了後より術後30日以内まで、「術後晩期合併症」を術後31日以降とし、それぞれの発生割合を算出する。
全治療例 (BTS例および緊急手術例) を分母とし、下記の合併症 についてそれぞれCTCAEv4.0 日本語訳JCOG版による最悪のgradeの頻度を求める。また、Clavien-Dindo 分類に存在する項目 (*を付記) はCTCAE v4.0 と併記する。
(1) 術中合併症
1) 心臓:心筋梗塞(虚血性心疾患)*、脳卒中*2) 血管:血栓・塞栓症*3) 傷害、中毒および処置合併症:術中肝胆道系損傷、術中脾臓損傷、術中消化管損傷、術中尿路損傷、術中動脈損傷、術中静脈損傷、術中神経系損傷(2) 術後早期合併症
1) 全身障害および投与局所様態:発熱2) 傷害、中毒および処置合併症:術後出血*、消化管縫合不全*、消化管吻合部狭窄*、創傷感染*、創し開*、腹壁瘢痕ヘルニア*、その他の創合併症、消化管ストーマ壊死、腸管ストーマ部出血、腸管ストーマ脱出、腸管ストーマ部漏出3) 感染症および寄生虫症:腹部感染(腹腔内膿瘍)*、骨盤内感染(骨盤内膿瘍)*、肺感染(肺炎)*、尿路感染4) 胃腸障害:下痢(小腸人工肛門のある患者も含め)*、腸炎、消化管出血、腸管廔*、腸管虚血・壊死*、閉塞性イレウス*、麻痺性イレウス*5) 腎および尿路障害:頻尿、残尿・尿閉*、尿路閉塞6) 血管障害:血栓症・塞栓症*(3) 術後晩期合併症
1) 手術創に関連する合併症:創傷感染*、創離開*、腹壁瘢痕ヘルニア*、その他の創合併症2) ストーマ関連合併症:腸管ストーマ部出血、腸管ストーマ脱出3) 胃腸障害:下痢(小腸人工肛門のある患者も含め)*、閉塞性イレウス*、麻痺性イレウス*
上記以外の合併症については、血液毒性以外のGrade3以上及び予期されないGrade2以上の合併症が観察された場合のみ治療経過記録用紙に記載するため、特定の合併症が多く観察された場合を除いて原則として発生割合は集計しない。
( 「血液毒性」 とは、CTCAEv4.0における「貧血」、「骨髄細胞減少」、「リンパ球数減少」、「好中球数減少」、「白血球数減少」、「血小板数減少」、「CD4リンパ球減少」とする。)
- 一期的腸管吻合率(BTS症例)
BTSで手術を施行した症例のうち一期的腸管吻合が可能であった症例の割合を算出する。これに伴う項目として人工肛門造設割合「人工肛門造設症例数/BTS手術施行症例数」、および人工肛門造設症例での人工肛門閉鎖割合「人工肛門閉鎖症例数/人工肛門造設症例数」も算出する。 - 全生存期間 (OS)
登録日を起算日とし、あらゆる原因による死亡日までの期間とする。また生存例は最終生存確認日をもって打ち切りとする。追跡不能症例は生存が確認された最終日をもって打ち切りとする。
10. 統計学的考察
10.1. 目標登録症例数の設定根拠
本研究は探索的研究であり、先行する研究のデータが不十分であるため、研究期間内での実施可能数を200例とした。
10.2. 解析対象集団
解析対象集団は全登録例とする。ただし、重大な研究計画書違反 (同意未取得など) があった症例は解析対象集団から除く。
10.3. 解析項目・方法
すべての統計解析は全体症例と、BTS症例、PAL症例それぞれでも行う。
- 大腸ステント留置術の臨床的成功率、大腸ステント留置術の手技的成功率、大腸ステント留置による合併症発生割合
各評価項目の割合とその95%信頼区間を算出する。 - 周術期合併症発生割合
事象ごとに最悪grade別の発生割合を算出する。 - 一期的腸管吻合率
各評価項目の割合とその95%信頼区間を算出する。 - 全生存期間 (OS)
Kaplan-Meier法により生存曲線を図示し、中央生存時間とその95%信頼区間並びに6ヶ月ごとの生存割合とその95%信頼区間を推定する。Circulating biomarkerのステント留置前後の変化ならびに手術後の値と生存期間の関連を検討する。
10.4. 中間解析
本研究では実施しない。
11. 症例報告書の記入と提出
11.1. 様式と提出期限
症例報告書(EDC)の様式は別添の「データベース」のごとくで、結腸直腸腫瘍閉塞の術前処置BTSおよび緩和治療を必要とする患者を認めたとき、大腸ステント留置術施行後すみやかにWebを介して「データベース」の登録確認票に入力する。治療後は適宜すみやかにその症例の「データベース」に記載されている項目をWeb上で記入し、データセンターに送付する。
11.2. 記入方法
各研究実施医療機関の研究者は、対象者が適格基準をすべて満たし、除外基準のいずれにも該当しない登録適格症例であることを確認し、文書による同意を取得する。その後、各研究実施医療機関の研究者または研究協力者は、Webで「データベース」の登録確認票を送信・登録を行い、登録完了を確認する。また、治療後の症例報告の詳細に関しては「データベース」に記載されている項目に関してWeb上で記入しデータセンターに送付する。
11.3. 送付方法
症例報告書(EDC)はWeb経由でデータセンターに送付され保存される。
11.4. 症例報告書内容の確認と問い合わせ
EDCに関する確認と問い合わせは下記メールアドレスにて受付し、回答する。
担当者:田丸 弓弦、松本 奈穂子
連絡先 〒737-0023 広島県呉市青山町3-1
独立行政法人国立病院機構呉医療センター・中国がんセンター 消化器内科
電話: 0823-22-3111(代表) FAX: 0823-21-0478 Mail: mailto:syoukakika-mc4@kure-nh.go.jp
担当者:田丸 弓弦、松本 奈穂子
連絡先 〒737-0023 広島県呉市青山町3-1
独立行政法人国立病院機構呉医療センター・中国がんセンター 消化器内科
電話: 0823-22-3111(代表) FAX: 0823-21-0478 Mail: mailto:syoukakika-mc4@kure-nh.go.jp
12. 研究管理
12.1. 進捗管理
本研究の進捗状況に関しては、データセンターにおいて、研究事務局が大腸ステント留置術施行後のフォローアップを監視する。研究責任者または研究責任者に指名された者が、入力・訂正の全てを実施し、必要に応じてEDC内で問合せを行う。研究責任者は全てのデータ入力が正確であることを確認する。
12.2. モニタリング
本研究は通常の診療を前向きに観察する観察研究であり、侵襲を伴わず介入を行わないため、モニタリングおよび監査は実施しない。
13. 倫理的事項
13.1. 遵守すべき諸規則
本研究に関わる全ての者は、「世界医師会ヘルシンキ宣言」、「人を対象とする医学系研究に関する倫理指針」、「個人情報の保護に関する法律」、を遵守して研究を実施する。
13.2. 説明と同意
研究責任者および研究分担者は、本研究の実施にあたり倫理的な配慮を慎重にし、各施設の倫理審査委員会において承認を得た説明文書を用いて研究内容について十分説明し、対象者の同意を取得する。研究に参加するか否かは、対象者本人の自由意思により決定され、同意後であっても、対象者本人の意思によりいつでも撤回が可能である。対象者は、同意撤回に伴う不利益を一切被らない。本研究で知り得た情報は、いかなる状況においても個人が同定できる形では公表せず、かつ厳重な管理下で保管される。また、対象者本人が希望すれば,本人の情報を本人のみに文書で公開する。
研究対象者に同意能力はあるが、視力障害等の理由により説明文書が読めない場合は、公正な立会人の立ち会いが、インフォームド・コンセントの過程に立ち会い、研究対象者本人に同意説明文書および研究対象者に提供された全ての文書を読み上げる。(公正な立会人とは研究の実施から独立し研究関係者から不当な影響を受けない人であって、インフォームド・コンセントの過程に立ち会い、同意説明文書および研究対象者に提供された全ての文書を読む者。研究責任者、研究分担者、研究協力者は立会人としては適当ではない。)公正な立会人は、同意文書に、自らと研究対象者との関係、立会日、立会人が必要な背景を記載し、署名する。
研究対象者に同意能力はあり、研究責任者または研究分担者が研究対象者本人の研究への参加について意思を確認できているが、麻痺等の理由により筆記が困難な場合は、代筆者を立てて研究対象者本人から同意を取得する。代筆者は、同意文書に、研究対象者名、自らと研究対象者との関係、代筆日、代筆者が必要な背景を記載し、署名する。
研究対象者に同意能力はあるが、視力障害等の理由により説明文書が読めない場合は、公正な立会人の立ち会いが、インフォームド・コンセントの過程に立ち会い、研究対象者本人に同意説明文書および研究対象者に提供された全ての文書を読み上げる。(公正な立会人とは研究の実施から独立し研究関係者から不当な影響を受けない人であって、インフォームド・コンセントの過程に立ち会い、同意説明文書および研究対象者に提供された全ての文書を読む者。研究責任者、研究分担者、研究協力者は立会人としては適当ではない。)公正な立会人は、同意文書に、自らと研究対象者との関係、立会日、立会人が必要な背景を記載し、署名する。
研究対象者に同意能力はあり、研究責任者または研究分担者が研究対象者本人の研究への参加について意思を確認できているが、麻痺等の理由により筆記が困難な場合は、代筆者を立てて研究対象者本人から同意を取得する。代筆者は、同意文書に、研究対象者名、自らと研究対象者との関係、代筆日、代筆者が必要な背景を記載し、署名する。
13.3. 説明文書・同意書(様式)の作成と改訂
- 説明文書・同意書および同意撤回書の様式
別添1-3参照。 - 承認・改訂の手続き
説明文書、同意書および同意撤回書については研究代表者が主体となって作成し、承認・改訂については各実施医療機関が設置する倫理審査委員会(もしくは審査を委託している倫理審査委員会)の承認を得るものとする。
13.4. 実施医療機関における実施許可の取得
本研究の実施にあたっては各実施医療機関が設置する倫理審査委員会(もしくは審査を委託している倫理審査委員会)での承認後、各実施医療機関の長の許可を得ることとする。
13.5. 個人情報の保護
本研究に携わる者は、対象者の個人情報等保護の原則を遵守する。本研究ではプライバシーを保護するため、研究対象者の氏名、現住所の詳細、電話番号、Eメールアドレス、勤務先情報、通学先情報等を収集しない。対象者の医療情報はEDCにて発番された症例登録番号を用いて同定され、研究の結果が公表される場合にも研究対象者のプライバシー保護に十分配慮する。
13.6. 研究対象者に生じる負担並びに予測されるリスク及び利益、これらの総合的評価並びに当該負担及びリスクを最小化する対策
13.6.1 負担並びに予測されるリスク
対象者は通常の診療に基づいて治療を受けるため、本研究に参加することにより生じる負担並びにリスクはない。
対象者は通常の診療に基づいて治療を受けるため、本研究に参加することにより生じる負担並びにリスクはない。
13.6.2. 予測される利益
本研究に参加することによる研究対象者個人への直接的な利益は生じない。研究の成果としては、将来の閉塞性大腸疾患の治療法の進歩に有益となる可能性がある。
本研究に参加することによる研究対象者個人への直接的な利益は生じない。研究の成果としては、将来の閉塞性大腸疾患の治療法の進歩に有益となる可能性がある。
13.6.3. 負担、リスク、利益の総合的評価並びに当該負担及びリスクを最小化する対策
本研究における診療は、通常の保険診療として行われるものであり、通常診療と比べて対象者の負担やリスクは増加しない。なお、通常診療において実施されているステント留置後の副作用として、PAL目的の場合には長期の観察で1割程度の再閉塞、1割程度の逸脱、4%程度の穿孔率が報告されている。
本研究における診療は、通常の保険診療として行われるものであり、通常診療と比べて対象者の負担やリスクは増加しない。なお、通常診療において実施されているステント留置後の副作用として、PAL目的の場合には長期の観察で1割程度の再閉塞、1割程度の逸脱、4%程度の穿孔率が報告されている。
14. 研究の費用負担
14.1. 研究の資金源及び利益相反
本研究は、下記の日本消化器内視鏡学会関連研究会である「大腸ステント安全手技研究会」を母体として実施される。
連絡先:〒153-8515 東京都目黒区大橋2-17-6 東邦大学医療センター大橋病院 外科内
大腸ステント安全手技研究会
代表世話人:斉田芳久 事務担当:榎本俊行
電話:03-3468-1251 FAX:03-3469-8506
また、本研究の主たる資金源は、大腸ステント安全手技研究会の研究費であり、その研究費は、日本消化器内視鏡学会からの補助金、各個人会員および賛助会員からの年会費、研究に賛同した企業からの研究寄付金であり、記載すべき経済的な利益関係や利益相反はない。研究者の個人的な利益相反の管理については、各実施医療機関の規定に従い、研究実施前に報告するものとする。
連絡先:〒153-8515 東京都目黒区大橋2-17-6 東邦大学医療センター大橋病院 外科内
大腸ステント安全手技研究会
代表世話人:斉田芳久 事務担当:榎本俊行
電話:03-3468-1251 FAX:03-3469-8506
また、本研究の主たる資金源は、大腸ステント安全手技研究会の研究費であり、その研究費は、日本消化器内視鏡学会からの補助金、各個人会員および賛助会員からの年会費、研究に賛同した企業からの研究寄付金であり、記載すべき経済的な利益関係や利益相反はない。研究者の個人的な利益相反の管理については、各実施医療機関の規定に従い、研究実施前に報告するものとする。
14.2. 臨床研究に関する研究対象者の費用負担
通常の診療と比較して、本研究に参加することにより治療費が増加することはない。
14.3. 健康被害に対する補償
本研究は観察研究であり、通常の診療を超える治療等を実施しないため、臨床研究における補償保険には加入しない。
15. 研究対象者への謝礼
本研究に参加することによる研究対象者への謝礼はない。
16. 研究計画書の改訂および研究責任者の変更
研究計画書の改訂および研究責任者の変更にあたっては、各実施医療機関が設置する倫理審査委員会(もしくは審査を委託している倫理審査委員会)での承認後、各実施医療機関の長の許可を得ることとする。
17. 試料・情報の保管及び廃棄
各実施医療機関の研究責任者は、研究等の実施に関わる文書(申請書類の控え、通知文書、研究対象者識別コードリスト、同意書、症例報告書等の控え、その他データの信頼性を保証するのに必要な書類または記録など)を各医療機関の施錠可能なロッカーや引き出しに保管する。また、研究代表者は症例報告書等を研究代表施設の医局の施錠可能なロッカーに保管する。保管期間は、研究の終了について報告された日から5年を経過した日又は研究結果の最終の公表について報告された日から3年を経過した日のいずれか遅い日までの期間とする。保管期間終了後に紙媒体に関してはシュレッダーで裁断し破棄する。その他媒体に関しては適切な方法で破棄する。
18. 試料・情報の二次利用
資料の保管期間にデータの二次利用を行う場合は,本研究事務局の承諾を得て研究のプロトコルを作成し,代表施設倫理審査委員会および研究実施施設倫理審査委員会にて審議の上,承認された場合,供与可能とする。
19. 研究の公表と成果の帰属
19.1. 研究登録
倫理審査委員会承認後、研究開始までに研究代表者は本研究の概要(研究の名称、目的、方法、実施体制、研究対象者の選定方針等)を大学病院医療情報ネットワーク研究センターの臨床試験登録システム(UMIN-CTR)に登録し、研究計画書の変更及び研究の進捗に応じて適宜更新する。また、研究を終了したときは、遅滞なく、当該研究の結果を登録する。
19.2. 研究結果の公表
本研究の結果は学会発表及び論文掲載で公表する予定である。
19.3. 成果の帰属
本研究の成果については、本研究の研究代表者、研究責任者、その他研究分担者・協力者等および大腸ステント安全手技研究会に帰属する。また学会発表および論文の著者は大腸ステント安全手技研究会にて決定する。
19.4. 研究機関の長への報告内容及び方法
以下の場合に文書にて実施医療機関の長に報告する。
- 研究の倫理的妥当性若しくは科学的合理性を損なう事実若しくは情報又は損なうおそれのある情報であって研究の継続に影響を与えると考えられるものを得た場合
- 研究の実施の適正性若しくは研究結果の信頼を損なう事実若しくは情報又は損なうおそれのある情報を得た場合
- 研究を終了(中止)した場合
- 研究の進捗状況及び研究の実施に伴う有害事象の発生状況(年に1回)
- 重篤な有害事象が発生した場合
20. 相談等への対応
研究対象者やその関係者からの相談窓口は、研究代表者、各実施医療機関の研究責任者とし、連絡先を説明文書に記載する。
21. 研究対象者の健康、子孫に受け継がれ得る遺伝的特徴等に関する重要な知見が得られた場合の研究結果の取扱い
本研究の実施に伴い、研究対象者の健康、子孫に受け継がれ得る遺伝的特徴等に関する重要な知見が得られる可能性はない。
22. 研究業務の委託
本研究で使用するデータセンターは下記の通りである。同データセンターは厳重なセキュリティーを行っており、個人情報保護に十分留意している。今までにいくつかの多施設臨床試験で使用しており、運用や個人情報保護の観点から問題ないと考えられる。株式会社NTT PC コミュニケーションズ(東京都千代田区神田神保町3-25 住友神保町ビル)のサーバー内にデータセンターを作成。Web上でアクセス可能である。上記サーバー、およびデータベースの管理は株式会社ファースト(東京都渋谷区代々木2-10-4 新宿辻ビル5 階・TEL 03-5332-6644・担当者 高橋 雄一)が行う。
23. 研究組織
23.1. 研究代表者(研究の統括、自施設での試料・情報の取得)
桑井 寿雄
連絡先 〒737-0023 広島県呉市青山町3-1
独立行政法人国立病院機構呉医療センター・中国がんセンター 消化器内科
電話 0823-22-3111 FAX 0823-21-0478
連絡先 〒737-0023 広島県呉市青山町3-1
独立行政法人国立病院機構呉医療センター・中国がんセンター 消化器内科
電話 0823-22-3111 FAX 0823-21-0478
23.2. 研究事務局(研究計画書に関する情報共有の窓口、重篤な有害事象発生時の情報共有の窓口)
田丸 弓弦
事務担当:松本 奈穂子
連絡先 〒737-0023 広島県呉市青山町3-1
独立行政法人国立病院機構呉医療センター・中国がんセンター 消化器内科
電話 0823-22-3111 FAX 0823-21-0478
事務担当:松本 奈穂子
連絡先 〒737-0023 広島県呉市青山町3-1
独立行政法人国立病院機構呉医療センター・中国がんセンター 消化器内科
電話 0823-22-3111 FAX 0823-21-0478
23.3. データセンター(データ管理、中央モニタリング)
株式会社ファースト
代表者:高橋 雄一
〒151-0053 東京都渋谷区代々木2-10-4 新宿辻ビル5階
TEL:03-5332-6644
代表者:高橋 雄一
〒151-0053 東京都渋谷区代々木2-10-4 新宿辻ビル5階
TEL:03-5332-6644
23.4. 共同研究機関(自施設での試料・情報の取得)
東邦大学医療センター大橋病院 消化器外科 研究責任者:斉田 芳久
順天堂大学医学部附属順天堂医院 消化器内科 研究責任者:伊佐山浩通
横浜新緑総合病院 外科 研究責任者:齊藤 修治
名古屋第二赤十字病院 消化器内科 研究責任者:山田 智則
東京大学医学部附属病院 消化器内科 研究責任者:石橋 嶺
日本医科大学 消化器外科 研究責任者:松田 明久
北野病院 消化器センター 消化器内科 研究責任者:山内 淳嗣
岩手県立胆沢病院 消化器内科 研究責任者:千葉 宏文
高槻病院 消化器内科 研究責任者:大須賀達也
順天堂大学医学部附属順天堂医院 消化器内科 研究責任者:伊佐山浩通
横浜新緑総合病院 外科 研究責任者:齊藤 修治
名古屋第二赤十字病院 消化器内科 研究責任者:山田 智則
東京大学医学部附属病院 消化器内科 研究責任者:石橋 嶺
日本医科大学 消化器外科 研究責任者:松田 明久
北野病院 消化器センター 消化器内科 研究責任者:山内 淳嗣
岩手県立胆沢病院 消化器内科 研究責任者:千葉 宏文
高槻病院 消化器内科 研究責任者:大須賀達也
24. 文献
1) Winner M, Mooney SJ, Hershman DL, et al: Incidence and predictors of bowel obstruction in elderly patients with stage IV colon cancer: a population-based cohort study. JAMA Surg 2013;148:715-722.
2) Jullumstro E, Wibe A, Lydersen S, et al: Colon cancer incidence, presentation, treatment and outcomes over 25 years. Colorectal Dis 2011;13:512-518.
3) Cheynel N, Cortet M, Lepage C, et al: Trends in frequency and management of obstructing colorectal cancers in a well-defined population. Dis Colon Rectum 2007; 50:1568-1575.
4) Cheynel N, Cortet M, Lepage C, et al. Trends in frequency and management of obstructing colorectal cancers in a well-defined population. Diseases of the colon and rectum 2007;50:1568-1575.
5) Moolla Z, Madiba TE. Trends in demographics and management of obstructing colorectal cancer. World journal of surgery 2014;38:2466-2470.
6) McArdle CS, Hole DJ. Emergency presentation of colorectal cancer is associated with poor 5-year survival. The British journal of surgery 2004;91:605-609.
7) 堂元又厳:閉塞性直腸癌のStentを用いた新内視鏡Prosthesis法.消内視鏡 1991;3:1507-1512.
8) Saida Y, Sumiyama Y, Nagao J, et al : Stent endoprosthesis for obstructing colorectal cancers. Dis Colon Rectum 1996;39:552-555.
9) Trompetas V: Emergency management of malignant acute left-sided colonic obstruction. Ann R Coll Surg Engl 2008;90:181-186.
10) ASGE Standards of Practice Committee, Harrison ME, Anderson MA, et al: The role of endos- copy in the management of patients with known and suspected colonic obstruction and pseudo- obstruction. Gastrointest Endosc 2010;71:669-679.
11) Ansaloni L, Andersson RE, Bazzoli F, et al: Guidelenines in the management of obstructing cancer of the left colon : consensus conference of the world society of emergency surgery (WSES) and peritoneum and surgery(PnS)society. World J Emerg Surg 2010;28:29.
12) Matsuzawa T, Ishida H, Yoshida S, et al. A Japanese prospective multicenter study of self-expandable metal stent placement for malignant colorectal obstruction: short-term safety and efficacy within 7 days of stent procedure in 513 cases. Gastrointest Endosc. 2015;82:697–707.e1.
13) 23(rd) UEG Week 2015: Barcelona, Spain, October 2015. United European Gastroenterol J. 2015;3:i.
14) Manes G, de Bellis M, Fuccio, et al. Endoscopic palliation in patients with incurable malignant colorectal obstruction by means of self-expanding metal stent: analysis of results and predictor of outcomes in a large multicenter series. Arch Surg 2011;146:1157-1162.
15) Kim BC, Han KS, Hong CW, et al. Clinical outcomes of palliative self-expanding metallic stents in patients with malignant colorectal obstruction. J Dig Dis 2012;13:258-266.
16) Small AJ, Coelho-Prabhu N, Baron TH. Endoscopic placement of self-expandable metal stents for malignant colonic obstruction: long-term outcomes and complication factors. Gasterointest Endosc 2010;71:560-572.
17) Sebastian S, Johnston S, Geoghegan T, et al. Pooled analysis of the efficacy and safety of self-expanding metal stenting in malignant colorectal obstruction. Am J Gastroenterol. 2004;99:2051–2057.
25. 付録
25.1. 診断基準
25.1.1. 原発巣 (大腸癌取り扱い規約 第9版)
- 癌の占居部位
癌の占居部位を大腸の区分に従って記載する。直腸癌および肛門管に占居する癌では腸壁の区分も記載する。 - 大腸,虫垂,肛門管の区分
- 結腸
C (盲腸):回盲弁の上唇より尾側の囊状部。上行結腸との境界は回盲弁の上唇の高さ。
A (上行結腸):盲腸に続き、右結腸曲に至る部分。
T (横行結腸):右および左結腸曲に挟まれた部分。
D (下行結腸):左結腸曲からS状結腸起始部 (ほぼ腸骨稜の高さ) に至る後腹膜に固定された部分。
S (S状結腸):下行結腸に続く部分で、腸骨稜に対応する部位より岬角の高さまで。 - 直腸
RS (直腸S状部):岬角の高さより第2仙椎下縁の高さまで。
Ra (上部直腸) :第2仙椎下縁の高さより腹膜反転部まで。
Rb (下部直腸) :腹膜反転部より恥骨直腸筋付着部上縁まで。 - 虫垂
V - 肛門管
P:肛門管には外科学的肛門管と解剖学的肛門管があり,前者は恥骨直腸筋付着部上縁より肛門縁までの管状部,後者は歯状線から肛門縁までの肛門上皮 (anoderm) に覆われた管状部をいう。本規約の記載には外科学的肛門管を用いる。
- 結腸
25.1.2. 組織学的所見 (大腸癌取り扱い規約 第8版)
1. 組織型
- 良性上皮性腫瘍
- 悪性上皮性腫瘍
2.1. 腺癌 Adenocarcinoma
2.1.1. 乳頭腺癌 Papillary adenocarcinoma (pap)2.2. 腺扁平上皮癌 Adenosquamous carcinoma (asc)
2.1.2. 管状腺癌 Tubular adenocarcinoma (tub)
2.1.2.1. 高分化 Well differentiated type (tub1)
2.1.2.2. 中分化 Moderately differentiated type (tub2)
2.1.3. 低分化腺癌 Poorly differentiated adenocarcinoma (por)
2.1.3.1. 充実型 Solid type (por1)
2.1.3.2. 非充実型 Non-solid type (por2)
2.1.4. 粘液癌 Mucinous adenocarcinoma (muc)
2.1.5. 印環細胞癌 Signet-ring cell carcinoma (sig)
2.1.6. 髄様癌 Medullary carcinoma
2.3. 扁平上皮癌 Squamous cell carcinoma (scc)
2.4. カルチノイド腫瘍 Carcinoid tumor
2.5. 内分泌細胞癌 Endocrine cell carcinoma
2.6. その他の癌 Miscellaneous histologcal types of malignant epithelial tumors
- 非上皮性腫瘍
- リンパ腫
- 分類不能の腫瘍
- 転移性腫瘍
- 腫瘍様病変
- 遺伝性腫瘍と消化管ポリポーシス
2. リンパ管侵襲〔ly〕
リンパ管侵襲とはリンパ管内への腫瘍細胞の侵入をいう。
LyX:
侵襲が不明である。
Ly0:
侵襲を認めない。
Ly1:
侵襲を認める。
Ly1a:
侵襲が軽度である。
Ly1b:
侵襲が中等度である。
Ly1c:
侵襲が高度である。
3. 静脈侵襲〔v〕
静脈侵襲とは血管内への腫瘍細胞の侵入をいう。
V2:肉眼的に侵襲を認める。
VX:
侵襲が不明である。
V0:
侵襲を認めない。
V1:
侵襲を認める。
V1a:
侵襲が軽度である。
V1b:
侵襲が中等度である。
V1c:
侵襲が高度である。
4. 簇出〔BD〕
簇出 (budding) とは癌発育先進部間質に浸潤性に存在する単個または5個未満の構成細胞からなる癌胞巣をいう。簇出が最も高度な領域を選択して20×10倍視野で癌発育先進部を観察し,簇出の個数をカウントする。注:T1癌について記載する。T2以深癌についても記載することが望ましい。
BDX:
簇出が不明である。
BD1:
0~4個。
BD2:
5~9個。
BD3:
10個以上。
5. 神経侵襲〔PN〕
PnX:
神経侵襲が不明である。
Pn0:
神経侵襲を認めない。
Pn1:
神経侵襲を認める。
Pn1a:
神経侵襲が壁内のみに存在する。
Pn1b:
神経侵襲が壁外に存在する。
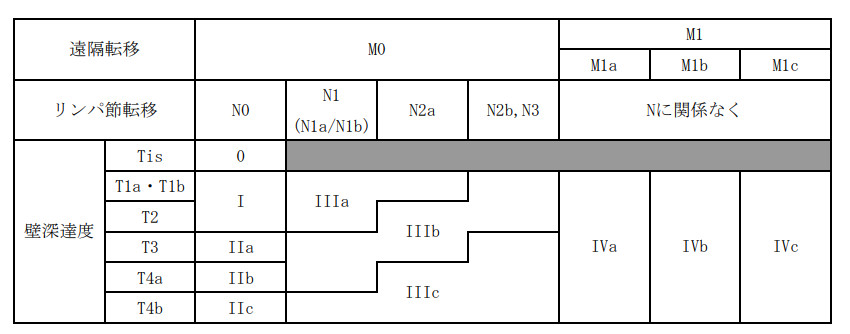
25.1.3. 進行度 (Stage) 分類 (大腸癌取り扱い規約 第9版)
1. 壁深達度〔T〕
TX:
壁深達度の評価ができない。
T0:
癌を認めない。
Tis:
癌が粘膜内 (M) にとどまり、粘膜下層 (SM) に及んでいない。
T1:
癌が粘膜下層 (SM) までにとどまり、固有筋層 (MP) に及んでいない。
T1a:
癌が粘膜下層 (SM) までにとどまり、浸潤距離が1000μm未満である。
T1b:
癌が粘膜下層 (SM) までにとどまり、浸潤距離が1000μm以上であるが固有筋層 (MP) に及んでいない。
T2:
癌が固有筋層 (MP) まで浸潤し、これを越えていない。
T3:
癌が固有筋層を越えて浸潤している。漿膜を有する部位では、癌が漿膜下層 (SS) までにとどまる。漿膜を有しない部位では、癌が外膜 (A) までにとどまる。
T4:
癌が漿膜表面に露出しているかまたは露出 (SE) ,あるいは直接他臓器に浸潤している(SI/AI) 。
T4a:
癌が漿膜表面に露出しているか,またはこれを破って腹腔に露出している (SE) 。
T4b:
癌が直接他臓器に浸潤している (SI/AI) 。
2. リンパ節転移〔N〕
NX:
リンパ節転移の程度が不明である。
N0:
リンパ節転移を認めない。
N1:
腸管傍リンパ節と中間リンパ節の転移総数が3個以下。
N1a:
転移個数が1個。
N1b:
転移個数が2~3個。
N2:
腸管傍リンパ節と中間リンパ節の転移総数が4個以上。
N2a:
転移個数が4~6個。
N2b:
転移個数が7個以上。
N3:
主リンパ節に転移を認める。下部直腸癌では側方リンパ節および/または側方リンパ節に転移を認める。
3. 遠隔転移〔M〕
MX:
遠隔転移の有無が不明。
M0:
遠隔転移を認めない。
M1:
遠隔転移を認める。
M1a:
1臓器に遠隔転移を認める (腹膜転移は除く) 。
M1b:
2臓器以上に遠隔転移を認める (腹膜転移は除く) 。
M1c:
腹膜転移を認める。
M1c1:
腹膜転移のみを認める。
M1c2:
腹膜転移およびその他の遠隔転移を認める。
4. 肝転移〔H〕
HX:
肝転移の有無が不明。
H0:
肝転移を認めない。
H1:
肝転移巣4個以下かつ最大径が5cm以下。
H2:
H1、H3以外。
H3:
肝転移巣5個以上かつ最大径が5cmを超える。
肝転移症例の予後分類 (Grade分類) を記載する。
Grade A
H1かつ原発巣のリンパ節がN0/N1
Grade B
H1かつ原発巣のリンパ節がN2、またはH2かつ原発巣のリンパ節がN0/N1
Grade C
上記以外
5. 腹膜転移〔P〕
PX:
腹膜転移の有無が不明。
P0:
腹膜転移を認めない。
P1:
近接腹膜にのみ播種性転移を認める。
P2:
遠隔腹膜に少数の播種性転移を認める。
P3:
遠隔腹膜に多数の播種性転移を認める。
6. 肺転移〔PUL〕
PULX:
肺転移の有無が不明。
PUL0:
肺転移を認めない。
PUL1:
肺転移が2個以下、または片側に3個以上。
PUL2:
肺転移が両側に3個以上、または癌性リンパ管炎、癌性胸膜炎、肺門部、縦隔リンパ節転移を認める。
Grade A:
肺転移個数1個かつDFI2年以上かつ原発巣のリンパ節がN0/N1、または肺転移個数が 1個かつDFI2年未満、または肺転移個数が2個または片側に3個以上かつ原発巣のリンパ節がN0
Grade B:
肺転移個数1個かつDFI2年以上かつ原発巣のリンパ節がN2/N3あるいはM1 (H)、または肺転移個数が1個かつDFI2年未満、または肺転移個数が2個または片側に3個以上かつ原発巣のリンパ節がN1/N2
Grade C:
上記以外
原発巣のリンパ節転移の程度と遠隔転移、PUL、無病期間 (disease free interval:DFI) で肺転移症例のGradeを決める。
DFIは原発巣手術日から肺転移確認日までの期間であり、同時性肺転移のDFIは0とする。
原発巣のリンパ節転移の程度と遠隔転移、PUL、無病期間 (disease free interval:DFI) で肺転移症例のGradeを決める。
DFIは原発巣手術日から肺転移確認日までの期間であり、同時性肺転移のDFIは0とする。
進行度分類 (Stage) は、臨床分類 (clinical classification) と病理分類 (pathological classification)を区分し、それぞれ小文字のc、pを進行度分類の前に付して表す(cStage、pStage)。
臨床分類 (cStage) は治療前の臨床所見に基づく分類であり、術中所見は進行度分類の判定には使用しない。
病理分類 (pStage) は病理所見に基づく分類である。ただし、遠隔転移 (M)の判定には臨床所見および/または術中所見を用いてもよい。
臨床分類 (cStage) は治療前の臨床所見に基づく分類であり、術中所見は進行度分類の判定には使用しない。
病理分類 (pStage) は病理所見に基づく分類である。ただし、遠隔転移 (M)の判定には臨床所見および/または術中所見を用いてもよい。
Stage 0 Tis N0 M0
Stage I T1,T2 N0 M0
Stage II T3,T4 N0 M0
Stage IIa T3 N0 M0
Stage IIb T4a N0 M0
Stage IIc T4b N0 M0
Stage III Tに関係なく N1,N2,N3 M0
Stage IIIa T1,T2 N1 M0, T1 N2a M0
Stage IIIb T1,T2 N2b,N3 M0, T3,T4a N1 M0, T2,T3 N2a M0
Stage IIIc T3,T4a N2b,N3 M0, T4b N1,N2,N3 M0, T4a N2a M0
Stage IV Tに関係なく Nに関係なく M1
Stage IVa Tに関係なく Nに関係なく M1a
Stage IVb Tに関係なく Nに関係なく M1b
Stage IVc Tに関係なく Nに関係なく M1c
TXおよび/またはNXであっても以下の場合は進行度分類が可能である。
TisN0M0 Stage0, TXNXM1 Stage IV
Stage I T1,T2 N0 M0
Stage II T3,T4 N0 M0
Stage IIa T3 N0 M0
Stage IIb T4a N0 M0
Stage IIc T4b N0 M0
Stage III Tに関係なく N1,N2,N3 M0
Stage IIIa T1,T2 N1 M0, T1 N2a M0
Stage IIIb T1,T2 N2b,N3 M0, T3,T4a N1 M0, T2,T3 N2a M0
Stage IIIc T3,T4a N2b,N3 M0, T4b N1,N2,N3 M0, T4a N2a M0
Stage IV Tに関係なく Nに関係なく M1
Stage IVa Tに関係なく Nに関係なく M1a
Stage IVb Tに関係なく Nに関係なく M1b
Stage IVc Tに関係なく Nに関係なく M1c
TXおよび/またはNXであっても以下の場合は進行度分類が可能である。
TisN0M0 Stage0, TXNXM1 Stage IV
大腸癌の進行度分類 (Stage)

25.1.4. 病期分類基準 (TNM分類第7版)
1. TNM 臨床分類
T-原発腫瘍TX :
原発腫瘍の評価が不可能
T0 :
原発腫瘍を認めない
Tis :
上皮内癌:上皮内または粘膜固有層に浸潤
T1 :
粘膜下層に浸潤する腫瘍
T2 :
固有筋層に浸潤する腫瘍
T3 :
漿膜下層または腹膜被膜のない結腸もしくは直腸の周囲組織に浸潤する腫瘍
T4 :
臓側腹膜を貫通する腫瘍、および/または他の臓器または組織に直接浸潤する腫瘍
T4a :
臓側腹膜を貫通する腫瘍
T4b :
他の臓器または組織に直接浸潤する腫瘍
NX :
所属リンパ節転移の評価が不可能
N0 :
所属リンパ節転移なし
N1 :
1~3個の所属リンパ節転移
N1a :
1個の所属リンパ節転移
N1b :
2-3個の所属リンパ節転移
N1c :
漿膜下層または腹膜被覆のない結腸もしくは直腸の周囲軟部組織内に腫瘍デポジットすなわち衛星結節があるが、所属リンパ節転移なし
N2 :
4個以上の所属リンパ節転移
N2a :
4-6個の所属リンパ節転移
N2b :
7個以上の所属リンパ節転移
M0 :
遠隔転移なし
M1 :
遠隔転移あり
M1a :
1 臓器 (肝臓、肺、卵巣、所属リンパ節以外のリンパ節) に限局する転移で腹膜転移なし
M1b :
2 つ以上の臓器への転移
M1c :
他の臓器への転移の有無にかかわらず腹膜への転移
結腸および直腸の進行度分類
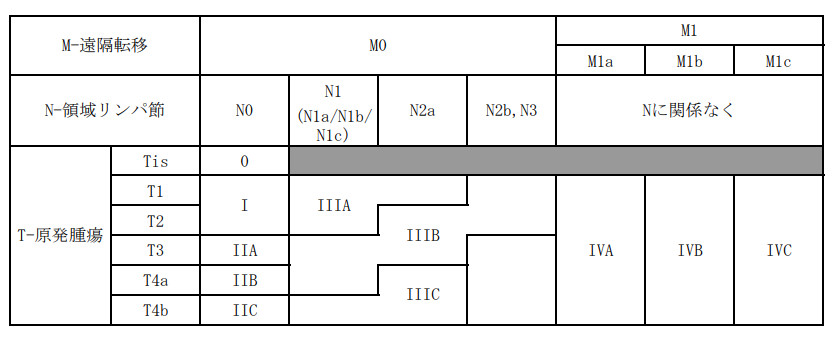
(TNM悪性腫瘍の分類,第8版,金原出版,2017より引用)

(TNM悪性腫瘍の分類,第8版,金原出版,2017より引用)
2. pTNM 病理学的分類
pT、pN各カテゴリーはT、N各カテゴリーに準ずる。pN0 : 所属リンパ節を郭清した標本を組織学的に検査すると、通常、12個以上のリンパ節が含まれる。通常の検索個数を満たしていなくても、すべてが転移陰性の場合は、pN0に分類する。
pM1 : 遠隔転移を顕微鏡的に確認。
pM0およびpMXというカテゴリーは用いない。
pM1という カテゴリーはM1の場合と同様に臓器転移部位を特定してもよい。
25.2. 手術治療
25.2.1. リンパ節郭清の程度
DX :
リンパ節郭清度が不明。
D0 :
腸管傍リンパ節の郭清が不完全である。
D1 :
腸管傍リンパ節が郭清された。
D2 :
腸管傍リンパ節および中間リンパ節が郭清された。
D3 :
腸管傍リンパ節,中間リンパ節および主リンパ節が郭清された。
25.2.2. 切除断端における癌浸潤
近位(⼝側)切離端〔PM〕PMX :
⼝側切離端の癌浸潤の有無が不明。
PM0 :
⼝側切離端に癌浸潤を認めない。
PM1 :
⼝側切離端に癌浸潤を認める。
遠位(肛⾨側)切離端〔DM〕
DMX :
肛⾨側切離端の癌浸潤の有無が不明。
DM0 :
肛⾨側切離端に癌浸潤を認めない。
DM1 :
肛⾨側切離端に癌浸潤を認める。
外科剥離⾯〔RM〕
RMX :
外科剥離⾯の癌浸潤の有無が不明。
RM0 :
外科剥離⾯に癌浸潤を認めない。
RM1 :
外科剥離⾯に癌浸潤を認める。
25.2.3. ⼿術治療後の癌遺残 〔R〕
RX :
癌遺残に関して判定できない。
R0 :
癌の遺残がない。
R1 :
切離端または剥離⾯が陽性。
R2 :
癌の⾁眼的な遺残がある。
25.2.4. 手術治療の根治度
根治度X(Cur X):
根治度が判定できない。
根治度A(Cur A):
遠隔転移がなく(M0)、かつ、切離端・剥離⾯がいずれも陰性である(PM0、DM0、RM0)。
根治度B(Cur B):
根治度A、根治度C に該当しない。
根治度C(Cur C):
明らかな癌遺残がある。